kesetimbangan dinamis
Kesetimbangan Dinamis
Jika kita mereaksikan larutan asam
klorida (HCl) dengan larutan natrium hidroksida (NaOH), maka akan
dihasilkan larutan natrium klorida (NaCl) dan air (H2O). Reaksi yang
terjadi antara larutan HCl dan NaOH adalah sebagai berikut:
 Bila
dipanaskan sampai jenuh, larutan NaCl dari hasil reaksi di atas akan
berubah menjadi kristal putih yang rasanya asin. Tetapi, jika kalian
mereaksikan kristal putih tersebut dengan air, maka tidak akan terbentuk
asam klorida (HCl) dan natrium hidroksida (NaOH). Reaksi tersebut
dinamakan reaksi satu arah (irreversible), karena hasil reaksi
(produk) tidak dapat diubah kembali menjadi pereaksi (reaktan).
Bagaimana cara kita mengidentifikasi bahwa suatu reaksi berlangsung satu
arah? Kalian ingin tahu caranya, bukan? Perhatikan ciri-ciri reaksi
satu arah berikut:
Bila
dipanaskan sampai jenuh, larutan NaCl dari hasil reaksi di atas akan
berubah menjadi kristal putih yang rasanya asin. Tetapi, jika kalian
mereaksikan kristal putih tersebut dengan air, maka tidak akan terbentuk
asam klorida (HCl) dan natrium hidroksida (NaOH). Reaksi tersebut
dinamakan reaksi satu arah (irreversible), karena hasil reaksi
(produk) tidak dapat diubah kembali menjadi pereaksi (reaktan).
Bagaimana cara kita mengidentifikasi bahwa suatu reaksi berlangsung satu
arah? Kalian ingin tahu caranya, bukan? Perhatikan ciri-ciri reaksi
satu arah berikut:- Antara pereaksi dan hasil reaksi dihubungkan dengan satu arah anak Panah
- Reaksi berlangsung tuntas. Maksudnya, reaksi akan berhenti bila salah satu atau semua pereaksi habis.
- Zat hasil reaksi tidak dapat diubah kembali menjadi pereaksi.
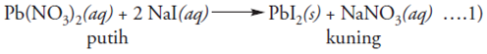
Selain reaksi di atas, kita dapat
mengambil contoh reaksi lain. Misalnya, reaksi antara larutan timbal
nitrat (Pb(NO3)2) yang berwarna putih dengan larutan natrium iodida
(NaI) yang jernih. Hasil reaksi menunjukkan terbentuknya endapan
berwarna kuning dari timbal iodida (PbI2) dan larutan natrium nitrat
(NaNO3), yang dapat dituliskan dalam persamaan reaksi berikut:
 Bila
direaksikan dengan NaNO3 berlebih, endapan PbI2 yang terbentuk dari
reaksi di atas akan kembali menjadi larutan Pb(NO3)2 yang berwarna putih
dan larutan NaI. Perhatikan reaksi berikut
Bila
direaksikan dengan NaNO3 berlebih, endapan PbI2 yang terbentuk dari
reaksi di atas akan kembali menjadi larutan Pb(NO3)2 yang berwarna putih
dan larutan NaI. Perhatikan reaksi berikut Berdasarkan
hasil reaksi pada reaksi 1 dan 2, diketahui bahwa pereaksi dapat
berubah menjadi hasil reaksi, dan sebaliknya. Oleh karena itu, reaksi 1
dan 2 disebut reaksi bolak-balik (reversible). Persamaan reaksinya yaitu:
Berdasarkan
hasil reaksi pada reaksi 1 dan 2, diketahui bahwa pereaksi dapat
berubah menjadi hasil reaksi, dan sebaliknya. Oleh karena itu, reaksi 1
dan 2 disebut reaksi bolak-balik (reversible). Persamaan reaksinya yaitu:- Antara pereaksi dan hasil reaksi dihubungkan dengan dua arah anak Panah
- Reaksi ke kanan disebut reaksi maju, sedangkan reaksi ke kiri disebut reaksi balik.
Pada reaksi bolak-balik, reaksi maju mempunyai laju reaksi yang dilambangkan dengan r1. Sementara itu, laju reaksi pada reaksi balik dilambangkan dengan r1. Jika reaksi bolak-balik mencapai suatu keadaan, saat r1 = r2, maka dapat disimpulkan bahwa reaksi tersebut mencapai keadaan setimbang, sehingga disebut reaksi kesetimbangan.
Pada saat mencapai keadaan setimbang,
reaksi dianggap selesai karena tidak terjadi perubahan yang dapat
dilihat dengan mata, misalnya konsentrasi dan warna. Tetapi, secara
mikroskopis, reaksi tersebut berlangsung terus menerus dan tidak
berhenti. Maksudnya, pereaksi di sebelah kiri selalu membentuk hasil
reaksi di sebelah kanan, dan sebaliknya. Keadaan itu berlangsung terus
menerus dengan laju yang sama, sehingga dapat dikatakan bahwa reaksi
tersebut mengalami kesetimbangan dinamis.
Kalian bisa menemukan contoh kesetimbangan dinamis dalam kehidupan
sehari-hari. Misalnya, orang yang sedang menaiki tangga escalator yang
bergerak turun. Jika kecepatan naiknya orang tersebut sama dengan
kecepatan turunnya eskalator, maka dikatakan mengalami ke setimbangan
dinamis.
Selain contoh di atas, kita bisa
memerhatikan peristiwa lain yaitu pemanasan air dalam wadah tertutup.
Jika air sudah mendidih dan menguap, maka uap air berubah kembali
menjadi air. Jika kecepatan terbentuknya uap air sama dengan kecepatan
terbentuknya air dari uap air, maka termasuk kesetimbangan dinamis.
Perhatikan reaksi berikut:
 Suatu
reaksi bolak-balik dapat berlangsung dalam berbagai wujud. Berdasarkan
wujud zat yang terlibat dalam reaksi, reaksi kesetimbangan dibedakan
menjadi dua, yaitu:
Suatu
reaksi bolak-balik dapat berlangsung dalam berbagai wujud. Berdasarkan
wujud zat yang terlibat dalam reaksi, reaksi kesetimbangan dibedakan
menjadi dua, yaitu:- Kesetimbangan homogen
- Kesetimbangan antara gas-gas
 Pada
saat terjadi kesetimbangan reaksi, ada beberapa kemungkinan perubahan
konsentrasi pada pereaksi dan hasil reaksi. Beberapa kemungkinan yang
terjadi pada kesetimbangan
Pada
saat terjadi kesetimbangan reaksi, ada beberapa kemungkinan perubahan
konsentrasi pada pereaksi dan hasil reaksi. Beberapa kemungkinan yang
terjadi pada kesetimbangan
Gambar : Grafik kemungkinan keadaan pereaksi dan hasil reaksi pada saat tercapaikeadaan setimbang
Pada gambar diatas, diketahui 3 kemungkinan yang terjadi pada pereaksi dan hasil reaksi saat tercapai keadaan setimbang, yaitu:
- Konsentrasi hasil reaksi lebih besar daripada konsentrasi pereaksi (Gambar a)
- Konsentrasi hasil reaksi lebih kecil daripada konsentrasi pereaksi(Gambar b)
- Konsentrasi hasil reaksi sama dengan konsentrasi pereaksi (Gambar c)
Dari Gambar diatas juga terlihat bahwa
pada saat setimbang, jumlah pereaksi dan hasil reaksi adalah konstan,
sehingga perbandingannya juga konstan.





0 Komentar:
Posting Komentar
Berlangganan Posting Komentar [Atom]
<< Beranda